Вода - наиболее распространенное на Земле вещество. Ее количество достигает 1018 тонн, и она покрывает приблизительно четыре пятых земной поверхности. Это единственное химическое соединение, которое в природных условиях существует в виде жидкости, твердого вещества (лед) и газа (пары воды). Вода играет жизненно важную роль в промышленности, быту и в лабораторной практике; она совершенно необходима для поддержания жизни. Приблизительно две трети человеческого тела приходятся на долю воды, и многие пищевые продукты состоят преимущественно из воды.
Благодаря широкой распространённости воды и её роли в жизни людей, она издавна считалась первоисточником жизни. Представление философов античности о воде как о начале всех вещей нашло отражение в учении (4 в. до н. э.) о четырёх стихиях (огне, воздухе, земле и воде), причём воды считалась носителем холода и влажности. Вплоть до конца 18 в. в науке существовало представление о воде как об индивидуальном химическом элементе. В 1781-82 английский учёный Г. Кавендиш впервые синтезировал воду, взрывая электрической искрой смесь водорода и кислорода, а в 1783 французский учёный А. Лавуазье, повторив эти опыты, впервые сделал правильный вывод, что вода есть соединение водорода и кислорода. В 1785 Лавуазье совместно с французским учёным Ж. Менье определил количественный состав В. В 1800 английские учёные У. Николсон и А. Карлейль разложили воду на элементы электрическим током. Таким образом, анализ и синтез воды показали сложность её состава и позволили установить для неё формулу H2O.
Изучение физических свойств воды началось ещё до установления её состава в тесной связи с другими научно-техническими проблемами. В 1612 итальянский учёный Г. Галилей обратил внимание на меньшую плотность льда сравнительно с жидкой водой как на причину плавучести льда. В 1665 голландский учёный Х. Гюйгенс предложил принять температуру кипения и температуру плавления воды за опорные точки шкалы термометра. В 1772 французский физик Делюк нашёл, что максимум плотности воды лежит при 4°С; при установлении в конце 18 в. метрической системы мер и весов это наблюдение было использовано для определения единицы массы - килограмма. В связи с изобретением паровой машины французские учёные Д. Араго и П. Дюлонг (1830) изучили зависимость давления насыщенного пара воды от температуры. В 1891-97 Д. И. Менделеев дал формулы зависимости плотности В. от температуры. В 1910 американский учёный П. Бриджмен и немецкий учёный Г. Тамман обнаружили у льда при высоком давлении несколько полиморфных модификаций. В 1932 американские учёные Э. Уошберн и Г. Юри открыли тяжёлую воду. Развитие физических методов исследования позволило существенно продвинуться в изучении структуры молекул В., а также строения кристаллов льда. В последние десятилетия особое внимание учёных привлекает структура жидкой воды и водных растворов.
Вода представляет собой прозрачную бесцветную жидкость, обладающую целым рядом аномальных физических свойств. Например, она имеет аномально высокие температуры замерзания и кипения, а также поверхностное натяжение. Ее удельные энтальпии испарения и плавления (в расчете на 1 г) выше, чем почти у всех остальных веществ. Редкой особенностью воды является то, что ее плотность в жидком состоянии при 4°С больше плотности льда. Поэтому лед плавает на поверхности воды.
Эти аномальные свойства воды объясняются существованием в ней водородных связей, которые связывают между собой молекулы как в жидком, так и в твердом состоянии. Вода плохо проводит электрический ток, но становится хорошим проводником, если в ней растворены даже небольшие количества ионных веществ.
Наиболее полно изучены свойства воды, благодаря которым возникла жизнь. Эти свойства сделали возможным существование живой природы в том диапазоне температур, который характерен для Земли как космического тела. Какие же это свойства?
Плотность воды
Одно из важнейших свойств воды - ее плотность. Максимальную плотность пресная вода имеет при 4 °С. При этой температуре один килограмм воды занимает минимальный объем (рис. 1). При понижении температуры от 4 °С до 0 плотность воды уменьшается, т. е. вода с температурой 4°С находится внизу, а более холодная поднимается наверх, где и замерзает, превращаясь в лед.
Плотность обычного льда - твердой кристаллической фазы воды - меньше плотности воды, поэтому лед плавает на поверхности, предохраняя воду от дальнейшего охлаждения. Он выступает в роли ледяной «шубы», защищающей пресноводный объект от полного промерзания. Так формируются условия для жизни обитателей водоемов при низких температурах.
Рис. 1. Объем, занимаемый 1 кг воды при различных температурах
В морской воде растворено значительное количество солей, и она ведет себя при охлаждении совершенно по-другому. Температура ее замерзания зависит от солесодержания, но в среднем составляет - 1,9°С. Максимальная плотность такой воды - при температуре -3,5°С. Морская вода превращается в лед, не достигая максимальной плотности. Поэтому происходит вертикальное перемешивание морской воды при ее охлаждении от плюсовой температуры до температуры замерзания. Благодаря такой циркуляции нижние горизонты океана обогащаются кислородом, а в верхние слои из нижних поступает вода, богатая питательными веществами. Необходимо отметить, что как морской, так и пресный лед легче воды и плавает на ее поверхности, предохраняя глубинные слои воды в морях и океанах от непосредственного контакта с холодными массами воздуха и способствуя тем самым сохранению тепла. В то же время искусственно при высоком давлении были получены разные модификации льда. Одни из них тяжелее воды, другие плавятся и, следовательно, замерзают при высокой температуре. Это так называемый «горячий лед». Поэтому всем нам повезло не только с наличием на Земле воды и солнечной радиации, но и с величиной атмосферного давления. Иначе вся Земля могла бы оказаться скованной ледяным панцирем.
Термодинамические свойства воды
Вода имеет особенные, аномальные свойства. В первую очередь это касается таких термодинамических констант, как теплоемкость воды, теплота парообразования, скрытая теплота плавления льда. Аномальный характер этих величин определяет большинство физико-химических и биологических процессов на Земле.
Удельная теплоемкость воды составляет 4,1868 кДж/(кг-К), что почти вдвое превышает удельную теплоемкость таких веществ, как этиловый спирт (2,847), растительное масло (2,091), парафин (2,911) и многие другие. А это значит, что при нагревании на одинаковое количество градусов вода способна воспринять почти вдвое больше тепла, чем перечисленные жидкости. Но и при остывании вода отдает больше тепла, чем другие жидкости. Поэтому при нагревании вод Мирового океана под воздействием солнечных лучей и их остывании при отсутствии энергии солнечной радиации теплоемкость выступает как свойство, обеспечивающее минимальные колебания температуры воды днем и ночью, летом и зимой.
Аномально высокое значение имеет теплота парообразования воды. Эта величина более чем вдвое превышает теплоту парообразования этанола, серной кислоты, анилина, ацетона и других веществ. Поэтому даже в самое жаркое время вода испаряется крайне медленно, что способствует ее сохранению и, следовательно, сохранению жизни на Земле. Высокое значение скрытой теплоты плавления льда также обеспечивает стабильность температурного режима на планете.
Одно из интересных свойств воды заключается в том, что ее наименьшая теплоемкость приходится на температуру 37 °С, а это значит, что при данной температуре необходимы минимальные энергетические затраты для ее изменения. Наверное, поэтому температура тела теплокровных существ близка к этому значению.
Вода имеет аномально высокие значения и других констант. Вещества, образованные соединением водорода со стоящими в одном ряду периодической таблицы кислородом, серой, селеном, теллуром, называются гидридами. Гидрид кислорода называется водой. Необычность свойств гидрида кислорода, по сравнению со свойствами других гидридов, заключается в том, что, в отличие от них, вода в обычных условиях (при нормальном давлении и температуре от 0 до 100 °С) находится в жидком состоянии, а не в газообразном. На рис. 2 представлены точки кипения и замерзания гидридов. Если бы вода не обладала аномальными значениями температуры кипения и замерзания, то эти процессы происходили бы при значительно более низких отрицательных температурах, и вода в жидком виде присутствовала бы на более холодных планетах. И следовательно, жизни на Земле не было бы.
Сила поверхностного натяжения воды
Есть и другие особые свойства воды, которые позволяют назвать ее поистине удивительнейшим соединением. Речь идет о поверхностном натяжении жидкости. Силы взаимодействия молекул, составляющих воду, притягивают их друг к другу, и разорвать эту связь не так просто.
Большинству людей известен школьный опыт, когда осторожно положенная в блюдце с водой иголка плавает на поверхности. Многие видели интереснейший фокус, когда в полный стакан воды опускают значительное количество монет и вода, не переливаясь через край, поднимается небольшим куполом. Наконец, известна библейская легенда о том, как Христос шел по воде. Все эти явления и легенды связаны с большим поверхностным натяжением воды. Благодаря поверхностному натяжению, вода поднимается по капиллярным каналам в грунте на поверхность Земли, поступает в ткани и клетки растений и живых организмов. Из всех известных жидкостей только у ртути сила поверхностного натяжения выше, чем у воды.
Известна очень интересная особенность воды, связанная с распространением в ней звуковых волн. Скорость распространения звука в воде аномально высока, она превышает скорость его распространения в воздухе почти в 6 раз.
Это были особенные свойства воды. Каковы же ее основные свойства при нормальном, пониженном и повышенном атмосферном давлении?
Свойства чистой воды
Чистая вода представляет собой прозрачную жидкость без цвета и запаха. При давлении 1 атм вода замерзает при температуре 0, а кипит при 100 °С. При повышении давления вдвое вода закипает при температуре 120 °С, а при понижении вдвое - при 81 °С. Однако при уменьшении давления температура плавления льда (или замерзания воды) повышается. Диаграмма состояний воды в области низких давлений представлена на рис. 3. Видно, что при низких давлениях вода может существовать только в виде льда или пара, а при высоких температурах - только в виде пара. Существуют также критические значения давления и температуры воды. При давлении свыше 22,1 атм. и температуре свыше 374,4°С исчезает разница между жидкостью и паром вода существует в газообразном состоянии.
Рис. 3. Диаграмма состояний воды в области низких давлений.
Удивительные значения давления и температуры атмосферы сложились на Земле, так как именно при этих значениях вода присутствует на планете в жидком виде, обеспечивая развитие всех существующих форм жизни. При этих параметрах происходит растворение в воде кислорода, необходимого для жизни водных организмов, а также для протекания процессов самоочищения воды. На протяжении многих тысячелетий наличие атмосферы, гидросферы и солнечного излучения создавало незначительный перепад температур летом и зимой, днем и ночью, обеспечивая условия для существования жизни.
Способность воды к растворению
Самая удивительная особенность воды - ее способность растворять другие вещества и ковалентные соединения. Вода широко используется в качестве растворителя в химической технологии, а также в лабораторной практике. Она представляет собой универсальный растворитель, необходимый для протекания биохимических реакций.
Способность воды хорошо растворять многие вещества обусловлена полярностью ее молекул. Молекула воды обладает сравнительно большим дипольным моментом. Поэтому при растворении в ней ионных веществ молекулы воды ориентируются вокруг ионов, т.е. сольватируют их. Водные растворы ионных веществ являются электролитами.
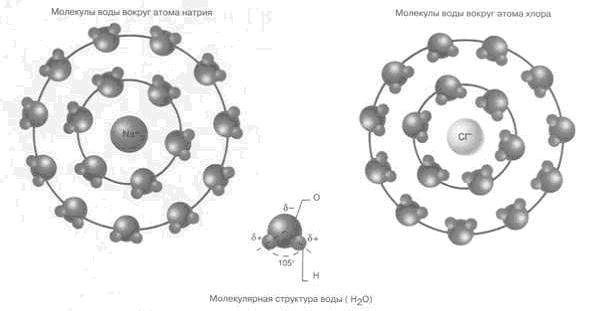
Растворимость ковалентных соединений в воде зависит от их способности образовывать водородные связи с молекулами воды. Водородные связи - это диполь-дипольные взаимодействия между атомами водорода в молекулах воды и электроотрицательными атомами молекул растворенного вещества. Простые ковалентные соединения, как, например, диоксид серы, аммиак и хлороводород, растворяются в воде. Кислород, азот и диоксид углерода плохо растворяются в воде. Многие органические соединения, содержащие атомы электроотрицательных элементов, как, например, кислорода или азота, растворимы в воде. В качестве примера укажем этанол С2Н5ОН, уксусную кислоту СН3СООН, сахар С12Н22О6 и диэтиламин (C2H5)2NH. Присутствие в воде нелетучих растворенных веществ, например хлорида натрия или сахара, понижает давление пара и температуру замерзания воды, но повышает ее температуру кипения.
В земной воде всегда что-то растворено. Это могут быть газы, молекулы или ионы химических элементов. Считается, что в водах Мирового океана могут быть растворены все элементы таблицы периодической системы элементов, по крайней мере, на сегодня их обнаружено более 80. Вода в природных условиях всегда содержит растворённые соли, газы и органические вещества. Их количественный состав меняется в зависимости от происхождения В. и окружающих условий. При концентрации солей до 1 г/кг воду считают пресной, до 25 г/кг - солоноватой, свыше - солёной. Наименее минерализованными водами являются атмосферные осадки (в среднем около 10-20 мг/кг), затем пресные озёра и реки (50-1000 мг/кг). Солёность океана колеблется около 35 г/кг; моря имеют меньшую минерализацию (Чёрное 17-22 г/кг; Балтийское 8-16 г/кг; Каспийское 11-13 г/кг). Минерализация подземных вод вблизи поверхности в условиях избыточного увлажнения составляет до 1 г/кг, в засушливых условиях до 100 г/кг, в глубинных артезианских водах минерализация колеблется в широких пределах. Максимальные концентрации солей наблюдаются в соляных озёрах (до 300 г/кг) и глубокозалегающих подземных В. (до 600 г/кг).
В пресных водах обычно преобладают ионы HCO3-, Са2+ и Mg2+. По мере увеличения общей минерализации растет концентрация ионов SO42-, Cl-, Na+ и К+. В высокоминерализованных водах преобладают ионы Cl- и Na+, реже Mg2+ и Ca2+. Прочие элементы содержатся в очень малых количествах, хотя почти все естественные элементы периодической системы найдены в природных водах.
Из растворённых газов в природных водах присутствуют азот, кислород, двуокись углерода, благородные газы, редко сероводород и углеводороды. Концентрация органических веществ невелика - в среднем в реках около 20 мг/л, в подземных водах ещё меньше, в океане около 4 мг/л. Исключение составляют воды болотные и нефтяных месторождений и вод, загрязнённые промышленными и бытовыми стоками, где количество их бывает выше. Качественный состав органических веществ чрезвычайно разнообразен и включает различные продукты жизнедеятельности организмов, населяющих вод, и соединения, образующиеся при распаде их остатков.
Первоисточниками солей природных вод являются вещества, образующиеся при химическом выветривании изверженных пород (Ca2+, Mg2+, Na+, К+ и др.), и вещества, выделявшиеся на протяжении всей истории Земли из её недр (CO2, SO2, HCI, NH3 и др.). От разнообразия состава этих веществ и условий, в которых происходило их взаимодействие с водой, зависит состав воды. Громадное значение для состава воды имеет и воздействие живых организмов.
Структура молекулы воды
С чем же связана высокая растворяющая способность воды? Какова структура воды. Как устроена молекула воды? Очевидно, что все особенности воды определяются теми химическими элементами, которые входят в ее состав. Эти элементы - водород и кислород - широко распространены как в Космосе, так и на Земле.
Вода-ковалентное молекулярное соединение. Молекула воды полярна; угол -104,5; связь O-H ковалентная полярная.
Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества). В каждой ее молекуле атом кислорода имеет две неподеленные пары электронов. Это объясняет изогнутую структуру молекулы воды с тетраэдрическим углом между связями.
Строение атома водорода
Наиболее распространенным во Вселенной элементом является водород. Атом водорода состоит из одного положительного заряда - протона, который находится в ядре, и одного отрицательного - электрона, который располагается на орбите. В ядре атома водорода может также находиться несколько нейтральных частиц - нейтронов, Их количество определяет «тяжесть» водорода. На рис. 4 представлено схематическое изображение атома водорода. Водород имеет три изотопа: протий 1H, дейтерий 2Н (или D) и тритий 3Н (или Т). Массовое число, обозначаемое верхним индексом, характеризует количество тяжелых частиц - нуклонов (протонов и нейтронов) - в ядре протия один протон, у дейтерия - один протон и один нейтрон, у трития - один протон и два нейтрона. В природной воде протий и дейтерий содержатся в соотношении 6800:1. Трития в природе ничтожно мало. Хотя положительный заряд ядра равен отрицательному заряду электрона, тем не менее один атом водорода способен заполнять свою единственную оболочку двумя электронами (создавать так называемые водородные связи) или отдавать этот электрон и становиться положительно заряженным ионом Ион водорода постоянно присутствует в воде, и его концентрация определяет один из важнейших показателей качества воды - активную реакцию воды рН.
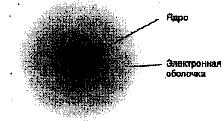
Рис. 4. Схематическое изображение атома водорода
Строение атома кислорода
Кислород - тоже замечательный элемент. Благодаря незаполненности электронной оболочки, на которой не хватает двух электронов, он обладает способностью вступать в реакции с другими элементами, являясь одним из самых активных химических элементов. Связанный кислород составляет более 85% гидросферы, более 45% литосферы и более 23% атмосферы. Кислород стоит на первом месте по числу образуемых минералов (1364), в живых организмах содержится около 70% кислорода, он входит в состав важнейших органических соединений - белков, жиров, аминокислот и т. д., в состав скелета. Исключительно велика роль кислорода в биохимических и физиологических процессах, особенно вдыхании. Практически все животные, растения и микроорганизмы (за исключением микробов-анаэробов) получают необходимую для жизнедеятельности энергию за счет биологического окисления различных веществ при помощи кислорода. Все окислительные процессы в природных водах, приводящие к самоочищению водных объектов, также протекают благодаря присутствию в воде кислорода.
В природе известны три разновидности кислорода - три стабильных изотопа кислорода: 16О, 18О (тяжелый) и 17О, среднее содержание которых составляет соответственно 99,759; 0,204 и 0,037% от общего числа атомов кислорода на Земле. Зги изотопы различаются количеством нейтральных частиц (нейтронов), входящих в состав ядра, при этом количество протонов в ядре одинаково и равно восьми. На рис. 5 приведено схематическое изображение атома кислорода. Особенностью атома кислорода является незаполненность внешней электронной оболочки; для этого не хватает двух электронов. Конфигурация атома кислорода записывается как 1s22s22р4 . Число электронов в атоме кислорода равно сумме верхних индексов при обозначении s- и p-орбиталей. На s-орбитали может присутствовать не более 2 электронов, на трех p-орбиталях - не более 6. S-орбитали у атома кислорода заняты полностью, на одной р-орбитали расположены два парных электрона, а двум p-орбиталям до заполнения не хватает 2 электронов. Способность атома кислорода к взаимодействию с другими веществами определяется именно этим.
Рис. 5. Схематическое изображение атома кислорода
Строение молекулы воды
Эти два элемента - водород и кислород - являются антагонистами. Один из них господствует в Космосе, другой - на Земле. Один (водород) стремится отдать единственный электрон своей электронной оболочки, а другой (кислород) стремится заполучить два электрона от других химических элементов.
Анализируя состав молекулы воды (рис. 6), можно сказать, что в ней два атома водорода и один атом кислорода «нашли друг друга».Таким образом, в составе воды, химическая формула которой записывается как Н20 теоретически могут присутствовать девять различны) стабильных видов воды (число перестановок из 5 по 3) Однако 99,97% всей води - в гидросфере представлено обычной водой вида 1Н2160. доля тяжелой воды 2Н2160 составляет менее 0,02%.
Рис. 6. Схематическое изображение молекулы воды.
Датский ученый Н. Бьеррум в 1951 г. предложил модель молекулы воды с точечным распределением зарядов. В соответствии с современными представлениями, молекула воды представляет собой тетраэдр (или пирамиду), в середине которого размещен центр молекулы, а в углах - электрические заряды.
Два положительных заряда соответствуют двум атомам водорода, каждый из которых «предоставил» свои электроны атому кислорода, и т отрицательных заряда, соответствующих «непарным» электронам кислорода. Таким образом, молекула воды представляет собой диполь, один из полюсов которого имеет положительный заряд, а другой - отрицательный. Полюсы диполя разнесены на некоторое расстояние, поэтому в электростатическом поле диполь воды разворачивается вдоль линий напряженности электрического поля. Если электростатическое поле образовано отрицательно заряженным ионом, то диполь воды разворачивается к этому иону своим положительным полюсом, и наоборот. Свойства воды как растворителя во многом определяются поляризованным строением ее молекулы. Высокая полярность молекул является причиной активности воды при химических взаимодействиях, при растворении в ней солей, кислот и оснований, т. е. при образовании электролитов. Вода способна растворять многие вещества, создавая с ними однородные физико-химические системы переменного состава. Растворенные в природных водах соли находятся в ионном состоянии, т. е. подвергнуты электролитической диссоциации.
Современной науке известно несколько моделей, с помощью которых можно разрешить многие аномальные свойства воды. Считается, что некоторые свойства определяются количеством ассоциаций молекул мономеров (Н2О)1, димеров (Н2О)2 и тримеров (Н2О)3, которые преимущественно присутствуют в воде при различных температурах.
Рис. 7. Кластеры воды.
Так, при температуре около нуля градусов Цельсия в воде присутствуют в основном тримеры, при температуре около 4°С - димеры, а в газообразном состоянии вода содержит главным образом мономеры. Иногда эти ассоциации называют тригидролями.
Некоторые ученые предлагают рассматривать воду как совокупность ассоциаций молекул, включая при этом в каждую ассоциацию от одной до восьми молекул. Другие считают, что структура воды представляет собой пространственное «кружево», образованное различными «мерцающими кластерами» (рис. 8). Третьи предлагают исследовать свойства воды с учетом особенностей строения ее молекулы, которые, в свою очередь, определяются особенностями составляющих молекулу воды элементов. В соответствии с современными представлениями, молекула воды похожа на маленький магнит.
Химические реакции с участием воды
Вода участвует во множестве химических реакций в качестве растворителя, реагента либо продукта. Выше уже обсуждались свойства воды как растворителя. Вода является продуктом многих неорганических и органических химический реакций. Например, она образуется при нейтрализации кислот и оснований. В органической химии многие реакции конденсации сопровождаются отщеплением (элиминированием) молекул воды. Существует четыре типа важнейших химических реакций, в которых вода участвует в качестве реагента.
Кислотно-основные реакции. Вода обладает амфотерными свойствами. Это означает, что она может выступать как в роли кислоты, так и в роли основания. Ее амфотерные свойства обусловлены способностью воды к самоионизации:
2Н2О(ж.) = Н3О+(водн.) + ОН-(водн.)
Это позволяет воде быть, с одной стороны, акцептором протона:
НСl + Н2О = Н3О+ + Сl
а с другой стороны-донором протона:
NH3 + Н2О = NH4 + ОН-
Окисление и восстановление. Вода обладает способностью выступать как в роли окислителя, так и в роли восстановителя. Она окисляет металлы, расположенные в электрохимическом ряду напряжений выше олова. Например, в реакции между натрием и водой происходит следующий окислительный процесс:
Nа(тв.) = Na+(водн.) + е-
В этой реакции вода играет роль восстановителя:
2Н2О(ж.) + 2е- = 2ОН-(водн.) + Н2(г.)
Другим примером подобной реакции является взаимодействие между магнием и водяным паром:
Мg(тв.) + Н20(г.) = МgО(тв.) + Н2(г.)
Вода действует как окислитель в процессах коррозии. Например, один из процессов, протекающих при ржавлении железа, заключается в следующем:
2Н2О + О2 + 4е- = 4ОН-
Вода является важным восстановителем в биохимических процессах. Например, некоторые стадии цикла лимонной кислоты включают окисление воды:
2Н2О = О2 + 4Н+ + 4е-
Этот процесс электронного переноса имеет также большое значение в восстановлении органических фосфатных соединений при фотосинтезе. Цикл лимонной кислоты и фотосинтез представляют собой сложные процессы, включающие ряд последовательно протекающих химических реакций. В обоих случаях процессы электронного переноса, происходящие в них, еще не полностью выяснены.
Гидратация. Выше уже указывалось, что молекулы воды способны сольватировать как катионы, так и анионы. Этот процесс называется гидратацией. Гидратная вода в кристаллах солей называется кристаллизационной водой. Молекулы воды обычно связаны с сольватируемым ими катионом координационными связями.
Гидролиз. Гидролиз представляет собой реакцию какого-либо иона или молекулы с водой. Примером реакций этого типа может быть реакция между хлороводородом и водой с образованием соляной кислоты. Другой пример-гидролиз хлорида железа(III):
FеС13(водн.) + ЗН2О(ж.) = Fе(ОН)3(тв.) + ЗН+(водн.) + ЗСl(водн.)
Гидролиз органических соединений также широко распространен. Один из наиболее известных примеров - гидролиз этилацетата (этилатаноата, этилового эфира уксусной кислоты):
СН3СООС2Н5 + Н2О = СН3СООН + С2Н5ОН
Этилацетат Уксусная кислота Этанол
Таким образом вода - уникальное природное соединение с уникальными физико-химическими свойствами, наличие которых определило функционирование жизни на Земле.















